当癌细胞获得在体内不同部位扩散并形成新肿瘤的能力(通常通过在血管或淋巴管内移动)时,就会发生转移。由于转移是晚期癌症的标志,并且使治疗严重复杂化,因此早期诊断至关重要。一种方法是在血液样本中寻找循环肿瘤细胞 (CTC)。
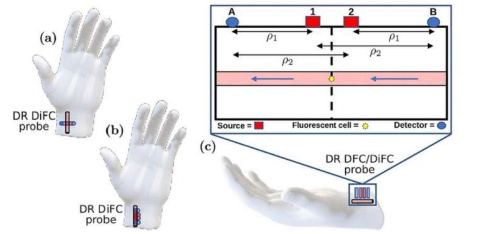
然而,CTC 可能非常罕见,尽管存在于患者的血液中,但它们在小量血液样本中可能完全不存在。为了解决这个问题,研究人员开发了一种称为弥散体内流式细胞术(DiFC)的技术。它包括用荧光剂标记 CTC,将激光直接照射到动脉上,然后使用检测器捕获发射的荧光信号来计算 CTC 的数量。
尽管前景广阔,但 DiFC 测量可能会受到背景噪声的严重影响,背景噪声主要源自周围组织的固有荧光(称为自发荧光 (AF))。
来自塔夫茨大学和美国马萨诸塞州东北大学的合作研究团队一直在积极尝试解决这一问题,并将东北团队开发的 DiFC 方法提升到一个新的水平。在发表在《生物医学光学杂志》(O) 上的最新研究中,研究人员测试了塔夫茨大学研究小组开发的一种称为双比率 (DR) 方法的新方法的能力,该方法可以最大限度地减少 DiFC 中的噪声,从而扩大其穿透范围。
DR 方法最初是为光谱技术而设计的,现在已被 DiFC 采用。由此产生的 DR DiFC 系统采用了两个激光源和两个在空间中精心排列的探测器。理论上,可以通过组合两个探测器的信号来消除噪声,并且使用 DR 方法也可以最大限度地减少被测介质表面(例如皮肤)的 AF 贡献。然而,DR DiFC 在什么条件下真正比标准 DiFC 更具优势仍不清楚。
研究人员通过三种方式解决了这一知识差距。他们使用各种噪声和 AF 参数以及不同的源探测器配置进行蒙特卡罗模拟。他们还使用带有模拟细胞荧光微球的人造组织模拟流动模型进行了 DR DiFC 实验。最后,研究小组测量了小鼠皮肤和底层肌肉的 AF,以深入了解噪声随组织类型和深度的变化。
实验表明,如果 DR 未消除的噪声部分低于 10%,并且对 AF 的贡献是表面加权的(靠近表面更高而不是均匀分布在目标体积中),则 DR DiFC 优于标准 DiFC。