首页 >> 综合 > 搜罗天下 >
科学家补充了亨廷顿机制的理论
莱斯大学的研究人员开始了解蛋白质片段如何影响被怀疑是亨廷顿病病因的纤维聚集。
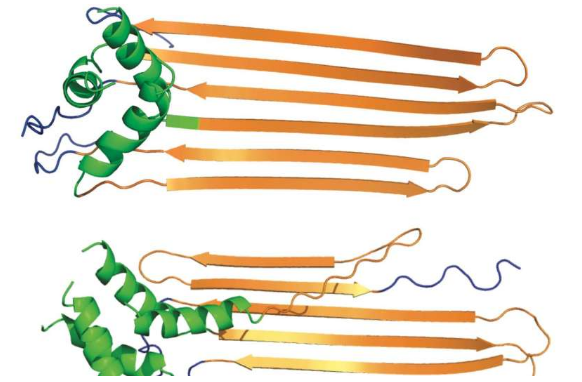
水稻生物科学家 Peter Wolynes 和研究生 Mingchen Chen 在计算机模拟中表明,亨廷顿蛋白片段中的 N 端序列促进其聚集成前原纤维结构,而由聚脯氨酸组成的 C 端序列则抑制聚集。
这些模型表明,它们的联合作用是他们在之前的一项研究中描述的聚集机制的一部分,该研究涉及聚谷氨酰胺的重复如何在遗传上引发亨廷顿舞蹈症。
Wolynes 表示,这一发现为药物带来了希望,这些药物可以干扰 N 末端结合,从而在过程的早期停止聚集。 “寻找目标涉及了解分子机制以及原子水平上的运作方式,我们正在添加故事的这一部分,”他说。
该研究的详细内容发表在《美国国家科学院院刊》上。
亨廷顿舞蹈症是一种由表达亨廷顿蛋白的基因突变引起的遗传性疾病,亨廷顿蛋白在人类神经元中很常见,而且大多无害。这种突变涉及谷氨酰胺的重复链,随着基因代代相传,该链的长度会增加。最终,当长度超过阈值时,触发聚合。当这些聚谷氨酰胺链达到 36 个重复的临界长度时,纤维通常开始在亨廷顿舞蹈症中聚集。较长的链会使疾病更加严重并且发病更早。
莱斯实验室研究了使蛋白质折叠成其功能形状的分子能量景观。这次,研究人员观察了大亨廷顿蛋白水解或分解后保留在细胞中的蛋白质片段。这些发夹样片段含有两端被 N 末端和 C 末端封端的多聚谷氨酰胺。
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
分享:
相关阅读
最新文章
-
【梦见被狼咬了是什么意思】梦境是人们潜意识的一种表达方式,不同的人对同一梦境可能有不同的解读。梦见被狼...浏览全文>>
-
【梦见被昆虫咬是什么意思】梦境是人类潜意识的反映,有时会带来不安或困惑。梦见被昆虫咬是一种常见的梦境,...浏览全文>>
-
【梦见被开除是什么征兆】梦境是人们内心情绪和潜意识的反映,不同的人在梦中会经历各种各样的场景。其中,“...浏览全文>>
-
【梦见被开除了什么征兆】梦境是潜意识的一种表达方式,有时会反映出我们内心的情绪、压力或对现实的担忧。梦...浏览全文>>
-
【梦见被开除了】在日常生活中,梦境往往是我们潜意识的反映。有些人会梦见自己被开除,这种梦境虽然让人感到...浏览全文>>
-
【梦见被警察抓是什么意思】梦境是人们潜意识的一种反映,不同的人对同一梦境可能会有不同的解读。其中,“梦...浏览全文>>
-
【梦见被解救是什么意思】梦境是人类潜意识的反映,不同的梦境往往象征着内心的情绪、压力或未解决的问题。其...浏览全文>>
-
【梦见被接受是什么意思】在日常生活中,梦境常常让人感到困惑或好奇。其中,“梦见被接受”是一种较为常见的...浏览全文>>
-
【梦见被黄鼠狼咬】梦境是人们潜意识的一种反映,常常蕴含着深层的心理信息。在许多文化中,梦到动物往往被认...浏览全文>>
-
【梦幻西游是什么游戏】《梦幻西游》是一款由中国网易公司自主研发的大型多人在线角色扮演游戏(MMORPG),自2...浏览全文>>
大家爱看
频道推荐
